Le proteine

Le proteine sono formate da carbonio, idrogeno, ossigeno ed azoto, possono avere sia caratteristiche acide che basice. Possiedono sia il gruppo amminico che carbossilico e sono molto presenti in natura. L'unità funzionale più piccola che forma la proteina è l'amminoacido (AA).
Funzioni
- Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi.
- Qualsiasi processo vitale dipende da questa classe di molecole ( ad esempio: la catolisi delle reazioni metaboliche, le difese immunitarie (immunoglobuline), il trasporto di ossigeno (emoglobina), il trasporto di nutrienti.
Sebbene in natura esistano più di 3000 amminoacidi, soltanto 20 sono incorporate nelle proteine dei mammiferi poichè sono gli unici codificati dal DNA. La caratteristica strutturale comune a tutte le proteine è di essere polimeri lineari di amminoacidi.
Struttura degli amminoacidi
Ogni amminoacido (eccetto la prolina) possiede un carbonio centrale, chiamato carbonio α (o chirale) al quale sono legati quattro differenti gruppi:
- un gruppo amminico basico (-NH2)
- un gruppo carbossilico acido (-COOH)
- un atomo di idrogeno (-H)
- una catena laterale, diversa per ciascun amminoacido

Come si legano due amminoacidi?

- Tutti gli amminoacidi (tranne la glicina) hanno l'atomo di carbonio legato a quattro gruppi diversi: il carbonio (asimmetrico) è quindi un centro chiralico o otticamente attivo.
- Gli amminoacidi che hanno un centro asimmetrico nel carbonio α, possono esistere in due forme speculari (D ed L) dette stereoisomeri, isomeri ottici o enantiomeri.
- Le proteine contengono solo L-amminoacidi.
Quando un amminoacido viene sciolto in H2O diventa uno ione dipolare (zwitterione) che può agire sia come acido (donatore di protoni) che come base (accettore di protoni)
Le sostanze che hanno questa doppia natura si definiscono anfotere o anfoliti.
Al PH fisiologico (valore attorno a 7,4) tutti gli amminoacidi hanno:
- il gruppo carbossilico dissociato
- si forma lo ione negativo carbossilato (-COO-)
- il gruppo amminico protonato (-NH3+)
Nelle proteine quasi tutti i gruppi carbossilici e amminici degli amminoacidi sono uniti in legami peptidici.Le proprietà di ciascun amminoacido dipendono dal tipo di catena laterale che fa si che esse si dividano in 2.

Le proteine sono costituite da amminoacidi:
- idrofobici (apolari)
- idrofili (polari)
- anfipatici (possiedono sia zone polari che non polari)
Gli amminoacidi possono essere classificati in base alle proprietà delle loro catene laterali (-R), considerando la loro polarità o non polarità. al PH fisiologico e quindi la tendenza ad interagire con l'acqua.
AMMINOACIDI CON GRUPPI -R ALIFATICI (NON POLARI)
- Glicina, alanina, volina, isoleucina,metionina, prolina
- Essendo apolari sono idrofobici, non ricevono nè cedono protoni e non formano legami idrogeno e ionici.
- La metionina è uno dei due amminoacidi contenenti zolfo.
- La prolina ha una caratteristica struttura ad anello, formata dalla catena laterale e dal suo gruppo amminico, e differisce dagli altri amminoacidi perchè contiene un gruppo imminico (R-NHR). E' sol moderatamente polare.
AMMINOACIDI CON GRUPPI -R AROMA
- Fenilalanina, tirosina, triptofano.
- Sono relativamente non polari e tutti e tre possono intervenire nelle interazioni idrofobiche. Tirosina e triptofano sono più polari della fenilalanina per la presenza di OH nel primo e dell’atomo di N nell’anello indolico nel secondo.
AMMINOACIDI CON GRUPPI -R POLARI, NON CARICHI
- Serina, treonina, cisteina, asparagina, glutammina.
- Presentano, sulla catena laterale dei gruppi polari, come -OH, sono quindi polari ma non carichi.
- formano legami idrogeno con l'acqua.
La polarità di serina e treonina è dovuta al gruppo ossidrilico (-OH), quella della cisteina al gruppo sulfidrilico (-SH), quella di asparagina e glutammina ai gruppi ammidici (-CONH2), dove sia la porzione carbonilica che quella amminica possono entrare in gioco
AMMINOACIDI CON GRUPPI -R CARICHI POSITIVAMENTE (BASICI)
- Lisina, arginina, istidina.
- Possono formare legami ionici.
- Le loro catene laterali, contenenti gruppi amminici, a PH fisiologico sono ionizzate ed hanno carica positiva.
AMMINOACIDI CON GRUPPI CARICHI -R CARICHI NEGATIVAMENTE (ACIDI)
- Acido aspartico, acido glutammico.
- Sono donatori di protoni.
- Possono formare legami ionici.
Dal punto di vista biochimico gli amminoacidi si possono classificare in:
- essenziali: quegli amminoacidi che una determinata specie non è in grado di sintetizzare ( o li sintetizza in quantità non sufficienti).
- non essenziali: quegli amminoacidi che una determinata specie è in grado di sintetizzare.
Proteine globulari e fibrose
Le proteine possono essere classificate in 2 gruppi principali: proteine globulari e fibrose.
Proteine globulari
- Le catene polipeptidiche sono ripiegate ed assumono una forma copatta,sferica o globulare.
- contengono più tipi di strutture secondarie
- Le proteine globulari, con struttura terziaria, contengono gruppi molto diversi di proteine che esistono sotto forma di molecole compatte e sferoidali. Esse contengono sia α-eliche che strutture ripiegate β. In genere la struttura primaria delle proteine globulari manca di sequenze ripetitive che sono invece responsabili delle conformazioni regolari delle proteine fibrose.
Proteine fibrose
- Hanno catene peptidiche disposte in lunghi fasci o in foglietti.
- In genere presentano un unico tipo di struttura secondaria.
- Sono insolubili in H2O per la presenza di elevata [ ] (concentrazione) di amminoacidi idrofobici.
- Sono adatte a ruoi strutturali.
La stuttura primaria di una proteina è definita dalla sequenza lineare dei residui amminoacidi uniti da legami covalenti.

Struttura secondaria
Strutture dovute ad interazioni "locali" di tipo ponte-H
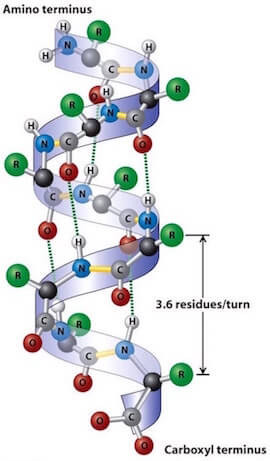
α-elica:
- interazioni H tra il gruppo carbonilico ed il gruppo amminico.
- il legame H si instaura tra l'H dell'azoto ammidico e l'O del gruppo carbonilico.
- i gruppi R sono esterni alla spirale.
- Può essere sinistrorso o destrorso.
β-foglietto:
- Legami idrogeno fra amminoacidi di catene diverse
- foglietto piegato tra due protoni

Struttura terziaria:
- La struttura terziara è la conformazione tridimensionale, avvolta da una proteina.
- Struttura primaria di una catena polipetidica, determina la sua struttura terziaria.
- Quando una proteina si avvolge su se stessa, gli AA (amminoacidi) che si trovano in regioni lontane dalla sequenza polipetidica possono ugualmente interagire tra loro.

Struttura quaternaria:
- Mote proteine sono costituite da una sola catena polipeptidica ( proteine monomeriche).
- Alcune proteine sono costituite da 2 o più catene polipeptidiche (subunità) strutturalmente identiche o diverse (proteine multimeriche).
- L'associazione di queste subunità costituisce la struttura quaternaria.
- Le subunità sono tenute insieme da interazioni non covalenti.






