La chimica organica si occupa di tutte le caratteristiche chimico-fisiche delle biomolecole organiche, ovvero i lipidi, i carboidrati, le proteine e gli acidi nuclei. Esse sono accomunate dalla presenza di una fondamentale molecola comune: il carbonio. Quest’ultimo, per formare le biomolecole, è solitamente unito ad altri atomi come l’idrogeno, l’ossigeno, l’azoto e il fosforo.
Il carbonio è un elemento molto versatile ed ha un numero atomico pari a 6. Sapendo che il numero atomico di un atomo nella tavola periodica indica il numero dei suoi elettroni, uguale anche al numero dei protoni, diremo, quindi, che il carbonio ha 6 elettroni. Essi nella configurazione elettronica si dispongono così:

Al primo livello gli elettroni sono due. Essi sono legati al nucleo da una forza e per questo non partecipano ai legami. Al secondo livello, quello in questo caso più esterno, vi sono 4 elettroni di valenza, chiamati così poichè sono quelli che partecipano ai legami. Di questi quattro elettroni, 2 si trovano nell'orbitale s e gli altri due nelle due orbitali p.
Come si può notare, il carbonio ha solo due orbitali 2p semipieni e, pertanto dovrebbe dare origine solamente a due legami covalenti. In realtà il carbonio è prevalentemente tetravalente, cioè in grado di formare 4 legami con altri atomi. Infatti si suppone la promozione di un elettrone dall’orbitale 2s all’orbitale 2p vuoto.

Tale atomo di carbonio eccitato ha ora quattro orbitali semipieni e potrebbe formare quattro legami.

Tuttavia, siccome l’orbitale atomico 2s sferico ha energia inferiore e forma diversa da quella dell’orbitale 2p, dovremmo aspettarci tre legami uguali ed uno diverso.
È qui che entra in gioco l’ibridazione.
IBRIDAZIONE
L’ibridazione, in chimica teorica, è un’operazione che consistente nel combinare matematicamente due o più orbitali atomici allo scopo di ottenere nuovi orbitali atomici (detti ibridi), con diverse caratteristiche spaziali, che permettono di descrivere in modo più accurato la formazione e la struttura delle molecole.
Quando l’atomo di carbonio forma legami con altri atomi può dar luogo a tre diverse configurazioni, ognuna delle quali corrisponde a una diversa combinazione degli orbitali atomici del secondo livello: ibridazione sp3, ibridazione sp2 e ibridazione sp.

IBRIDAZIONE SP3
Il concetto di ibridazione prevede che quando l’atomo di carbonio reagisce con quattro altri atomi, l’orbitale atomico 2s e i 3 orbitali 2p si mescolino per diventare quattro orbitali ibridi identici con diverse densità di elettroni e diverse orientazioni spaziali.
I quattro nuovi orbitali ibridi vengono chiamati sp3, perché hanno per ¼ il carattere s e per ¾ il carattere p.
Le singole orbitali sp3 assumono la seguente forma:

I quattro orbitali ibridi sp3 puntano verso i vertici di un tetraedro, disponendosi a 109,5° l’uno dall’altro.
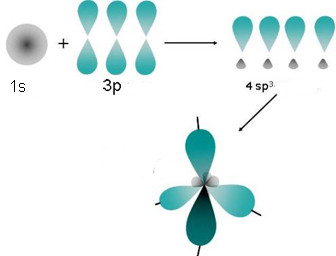
Se, ad esempio, mettiamo vicino un carbonio ibridato sp3 con un altro elemento, questi potranno formare soltanto un legame fra di loro. Questo perché le orbitali sp3 formano soltanto dei legami di tipo sigma, con simbolo σ. Quest’ultimi sono dei legami covalenti abbastanza forti che possono essere formati soltanto una volta tra due elementi, quindi non si possono avere due legami sigma tra gli stessi atomi. Per questo nei carboni ibridati sp3, ogni orbitale ibrido può legare soltanto un altro elemento con un singolo legame. Quindi il legame formerà quattro legami singoli con altri quattro elementi.
IBRIDAZIONE SP2
In questo caso solo due dei tre orbitali 2p si mescolano con l’orbitale 2s fino a formare tre nuovi orbitali ibridi, mentre un orbitale 2p ne resta fuori. I tre orbitali ibridi, sono disposti su un piano a una distanza reciproca di 120°, mentre l’orbitale non ibridato 2pz è perpendicolare al piano in cui giacciono gli elettroni. I tre nuovi orbitali hanno per 1/3 il carattere s e per 2/3 il carattere p e per questo sono detti sp2.
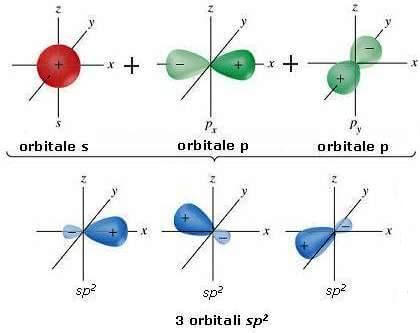
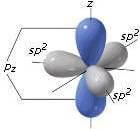
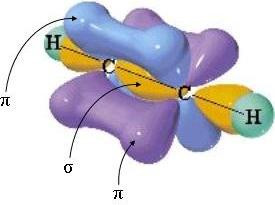
Se prendiamo il caso dell'etilene avremo due carboni, entrambi ibridati sp2, legati da un legam doppio. Questo perché un’orbitale ibridata sp2 di un carbonio si unisce ad un’altra orbitale sp2dell’altro carbonio, formando così un legame sigma. Le orbitali 2pz di entrambi i carboni si legano fra loro formando un legame pi greco, con il simbolo π. Questi due legami insieme formano costituiscono un legame doppio. Quindi, i due carboni sono legati con un legame doppio e le altre quattro orbitali, due per carbonio, che rimangono si legano con altri quattro elementi con un legame sigma.
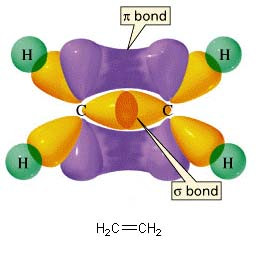
IBRIDAZIONE SP
In questo caso abbiamo che solo uno dei tre orbitali 2p si mescola con l’orbitale 2s fino a formare due nuovi orbitali ibridi, mentre gli altri due orbitali 2p mantengono la loro forma. I due orbitali ibridi si dispongono in linea, dunque ad una distanza reciproca di 180° e sono detti sp perché hanno per metà il carattere s e per metà quello p.

Prendendo, ad esempio, una molecola di acetilene, avremo due carboni legati da un legame triplo. Questo avviene perché un’orbitale ibridata di un carbone si unirà a un’altra orbitale ibridata dell’altro carbone, formando così un legame sigma; le orbitali 2py e 2pz, invece, formano con i loro corrispettivi dell’altro atomo di carbonio due legami pi greco. Questi tre legami insieme formano un legame triplo. Le altre due orbitali ibridate, un di uno e una dell’altro carbonio, si legheranno con altri due elementi attraverso dei legami sigma.
ISOMERIA
Una caratteristica delle molecole organiche è quella di essere presente in più forme isomere.
L’isomeria è un termine che viene utilizzato per definire quei composti che, pur avendo identica formula bruta e quindi la setta massa molecolare, presentano proprietà chimico-fisiche, strutture e disposizioni nello spazio diverse.
Esisono diversi tipi di isomeria:
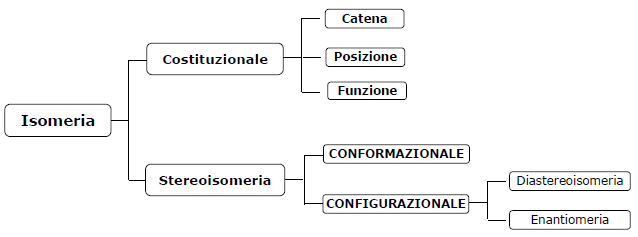
ISOMERIA COSTITUZIONALE
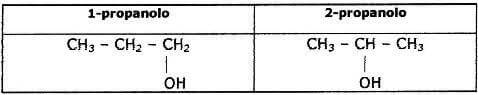
Gli isomeri costituzionali sono quei composti che hanno formule brute identiche ma differiscono gli uni dagli altri poiché i loro atomi di carbonio sono uniti fra loro in un ordine differente. Vi sono tre tipi di isomeria costituzionale:
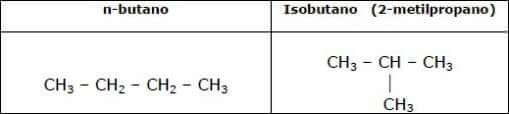
gli isomeri di catena, chiamati così perché differiscono per il modo in cui gli atomi di carbonio sono legati tra loro;
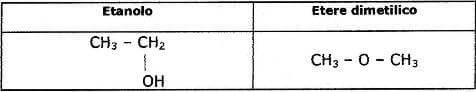
STEREOISOMERIA
La stereoisomeria è un particolare tipo di isomeria che si ha in quei composti che, pur avendo la stessa formula bruta e pur avendo gli atomi legati nello stesso identico ordine, differiscono in una diversa disposizione spaziale degli atomi.
Esistono due tipi di stereoisomeria: l’isomeria conformazionale e l’isomeria configurazionale.
L’isomeria conformazionale trova origine nella possibilità di rotazione attorno al legame singolo carbonio–carbonio che porta la molecola ad assetti spaziali interconvertibili senza rottura di legami chimici. Questa avviene, anche a temperatura ambiente, ad una frequenza tale da impedirne la separazione.
In questa rotazione, sono possibili un numero infinito di strutture chiamate conformeri o rotameri. L a molecola dell'etano C2H6 presenta due conformazioni fondamentali:
la conformazione sfalsata è quella in cui gli atomi di idrogeno risultano perfettamente sfalsati se la molecola viene osservata allo stesso modo. Questa conformazione risulta più stabile di quella eclissata in quanto tutti gli atomi si trovano alla massima distanza l’uno dall’altro e perciò esercitano tra loro la minore repulsione.

L’isomeria configurazionale si ha quando gli isomeri possono essere trasformati l’uno nell’altro solo attraverso una rottura dei legami e una loro ricombinazione. L’isomeria configurazionale comprende due sottogruppi:
Gruppi funzionali
In tutte le sostanze organiche, esclusi gli idrocarburi, compaiono una limitata serie di atomi o gruppi atomici ben definiti chiamati gruppi funzionali.
Ogni gruppo funzionale contraddistingue una specifica famiglia di composti organici con caratteristiche chimico-fisiche comuni.
|
Gruppo funzionale |
Formula generale |
Classe |
|
Ossidrilico |
-OH |
Alcoli, fenoli |
|
Tiolico |
-SH |
Tioli |
|
Aldeidico |
-CH=O |
Aldeidi |
|
Chetonico |
>C=O |
Chetoni |
|
Etereo |
-O- |
Eteri |
|
Tioetereo |
-S- |
Tioeteri |
|
Carbossilico |
-COOH |
Acidi carbossilici |
|
Estereo |
-O-CO- oppure -COO |
Esteri |
|
Amminico |
-NH2 |
Ammina |
|
Ammidico |
-CO-NH- |
Ammidi |
|
Nitrilico |
-CN |
Nitrili |
|
Alogeno |
-X ( x sono gli alogeni) |
Alogenoderivati |
|
Nitro |
-NO2 |
Nitroderivati |
|
Solfonico |
-SO3H |
Alcoli silfonici |
I gruppi funzionali: