PROTEINE
Le proteine o protidi (dal greco protos, "primario") rappresentano un ampio gruppo di composti organici formati principalmente da quattro elementi: Carbonio (C), Idrogeno (H), Ossigeno (O) eAzoto (N).
Le proteine inoltre possono essere sia basiche che acide.

Le proteine rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi.
In base alla loro funzione possono essere distinte in:
AMMINOACIDI
Gli amminoacidi (AA) sono le unità elementari e fondamentali delle proteine. Per formare una proteina essi si trovano in grandi quantità.
Sebbene in natura esistano più di 300 amminoacidi, soltanto 20 sono incorporati nelle proteine dei mammiferi poichè sono gli unici codificati dal DNA.
Gli amminoacidi vengono definiti:
STRUTTURA
Ogni amminoacido, tranne la prolina, possiede un carbonio centrale, chiamato carbonio α, al quale sono legati quattro differenti gruppi:
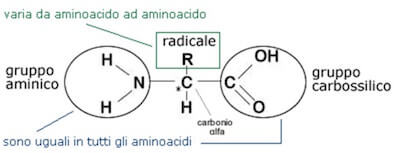
Tutti gli amminoacidi hanno l’atomo di carbonio α legato a quattro gruppi diversi, per questo viene chiamato anche carbonio asimmetrico ed è un centro chiralico.
Eccezione viene fatta dalla glicina che presenta due atomi di idrogeno ataccati al carbonio α.

Gli amminoacidi che hanno un centro asimmetrico nel carbonio α possono esistere due forme speculiari, D ed L, dette stereoisomeri, isomeri ottici o enantiomeri.
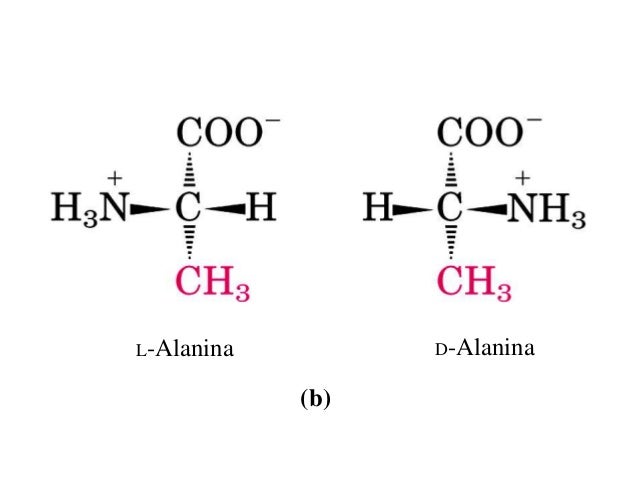
Quando un amminoacido viene sciolto in H2O diventa uno ione dipolare (zwitterione) che può agire sia come acido (donatore di protoni) che come base (accettore di protoni).
Le sostanze che hanno questa doppia natura si definiscono anfòtere o anfoliti.
Al pH fisiologico (valore attorno a 7,4) tutti gli amminoacidi hanno:
LEGAMI PEPTIDICI
Nelle proteine gli amminoacidi sono legati tra loro attraverso legami peptidici che si formano percondensazione tra i gruppi carbossilici e quelli amminici.

Una sequenza formata da due amminoacidi è detta dipeptide; quando ve ne sono più di due si forma una catena detta polipeptide.
CATENE LATERALI
Le proprietà e i ruoli di ciascun amminoacido in una proteina dipendono dalle catene laterali (-R) che sono i gruppi funzionali responsabili della struttura, delle funzioni e della carica elettrica delle proteine.

Gli amminoacidi possono essere classificati in base alle proprietà delle loro catene laterali (-R), considerando la loro polarità o non polarità al pH fisiologico e quindi la tendenza ad interagire con l’acqua:
AMMINOACIDI CON GRUPPI –R APOLARI
Essendo apolari sono idrofobici, per questo non ricevono né cedono protoni e non formano legami a idrogeno e ionici.
Essi sono: la glicina, l’alanina, la valina, la leucina, la isoleucina, la metionina e prolina.

Alcuni sono dei casi particolari:
AMMINOACIDI CON GRUPPI –R AROMATICI
Tra gli aromatici vi sono la fenialanina e il triptofano, che sono apolari, e la tirosina, che è polare.
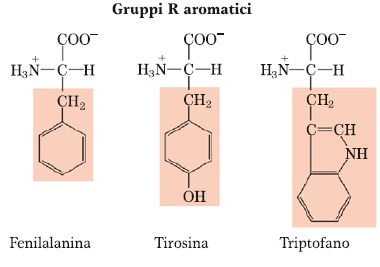
Le loro catene laterali sono aromatiche, cioè contengono uno o più anelli aromatici con doppi legami alternati.
Inoltre, i gruppi -OH della tirosina ed -NH del triptofano possono formare legami a idrogeno.
AMMINOACIDI CON GRUPPI –R POLARI, NON CARICHI
Essi sono: la serina, la treonina, la cisteina, l’asparagina, la glutammina.
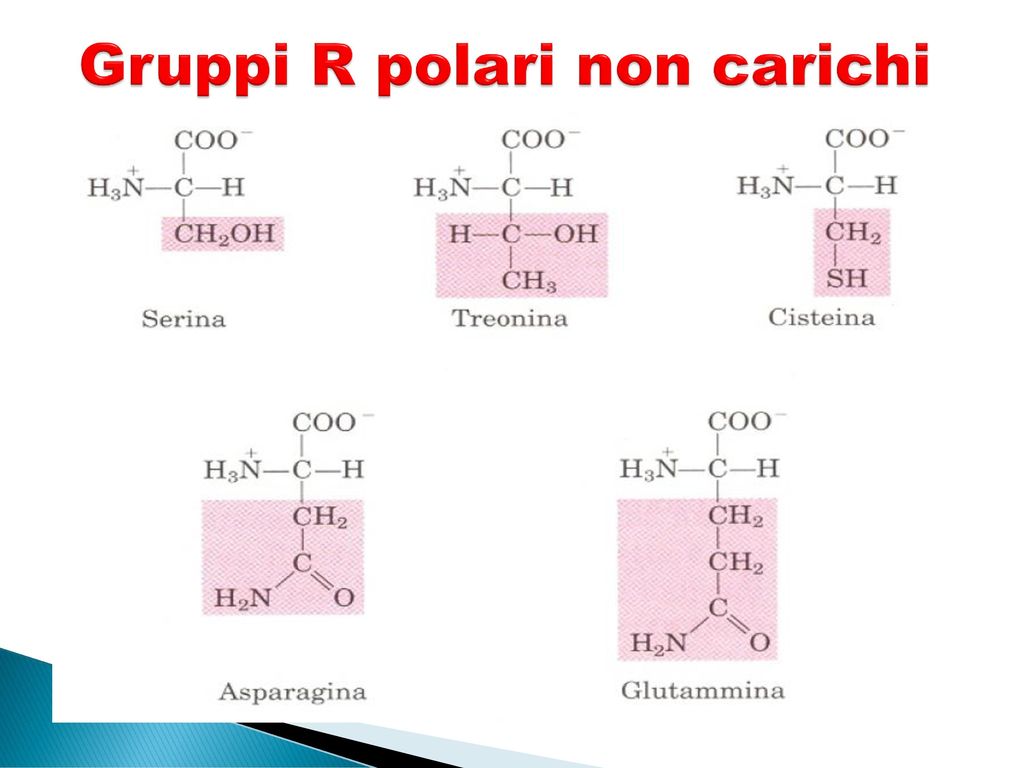
Sono polari ma in condizioni fisiologiche sono privi di carica elettrica.
Formano legami idrogeno con l’acqua.
La polarità di serina e treonina è dovuta al gruppo ossidrilico (-OH), quella della cisteina al gruppo sulfidrilico (-SH), quella di asparagina e glutammina ai gruppi ammidici (-CONH2), dove sia la porzione carbonilica che quella amminica possono entrare in gioco.
AMMINOACIDI CON GRUPPI-R CARICHI POSITIVAMENTE (BASICI)
Essi sono: la lisina, l'arginina e l'istidina.
Essi possono formare legami ionici e le loro catene laterali, contenenti gruppi amminici, a pH fisiologico sono ionizzate ed hanno carica positiva.
AMMINOACIDI CON GRUPPI -R CARICHI NEGATIVAMENTE (ACIDI)
Essi sono: l'acido aspartico (o aspartato) e l'acido glutamminico (o glutammato).
Essi sono donatori di protoni e possono formare legami ionici.
Inoltre, i gruppi carbossilici delle loro catene laterali al pH fisiologico, sono ionizzti ed hanno carica negativa.
PROTEINE GLOBULARI E FIBROSE
Le proteine possono essere classificate in due gruppi principali: proteine globulari e fibrose.
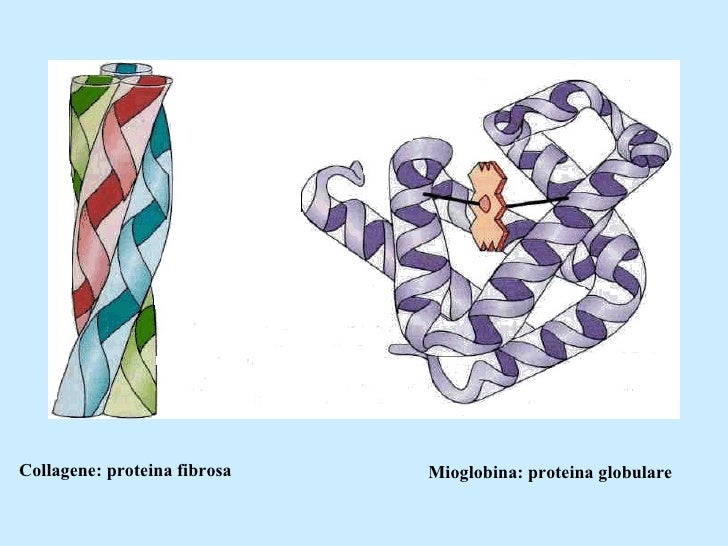
PROTEINE GLOBULARI
Le catene polipeptidiche delle proteine globulari sono ripiegate ed assumono forma compatta, sferica o globulare.
Esse contengono più tipi di struttura secondaria e comprendono : enzimi, proteine di trasporto ( come albumina ed emoglobina), proteine regolatrici, immunoglobuline, ecc…
PROTEINE FIBROSE
Le proteine fibrose hanno catene polipeptidiche disposte in lunghi fasci o in foglietti.
In genere presentano un unico tipo di struttura secondaria e sono insolubili in acqua per la presenza di elevate concentrazioni di amminoacidi idrofobici. Inoltre sono adatte a ruoli strutturali.