1.1 Ibridazione
L'ibridazione (o ibridizzazione) è un procedimento di combinazione matematica di un certo numero di orbitali (orbitali s, p, d) con contenuto energetico poco diverso (quindi orbitali di valenza) di uno stesso atomo che permette di ottenere nuovi orbitali ibridi equivalenti (isoenergetici) con i lobi orientati lungo le direzioni dei possibili legami che l'atomo centrale di una o più molecole può formare con altri atomi. La caratteristica più importante degli orbitali ibridi è il loro "carattere direzionale". Il numero di orbitali ibridi ottenuti è uguale al numero di quelli che vengono combinati, cosicché il numero totale di orbitali di valenza dell'atomo non cambia.
1.2 Tipi di Ibridazioni
Le ibridizzazioni degli orbitali s e p possono essere di tipo:
• Sp: In questa ibridizzazione abbiamo soltanto due orbitali ibridi isoenergetici perfettamente equivalenti orientati simmetricamente su una linea in modo da formare un angolo di 180° (struttura lineare); il terzo e il quarto orbitale sono di tipo p e si dispongono su piani mutuamente perpendicolari e perpendicolari alla linea su cui si trovano i due orbitali ibridi.
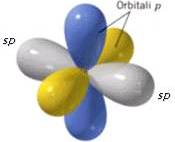
• sp2 :In questa ibridizzazione abbiamo tre orbitali ibridi isoenergetici perfettamente equivalenti orientati simmetricamente in un piano in modo da formare angoli di 120°,cioè l’angolo che corrisponde alla cosiddetta struttura triangolare; il quarto orbitale è di tipo p e ha i lobi perpendicolari alpiano su cui si trovano i tre orbitali ibridi.
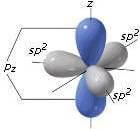
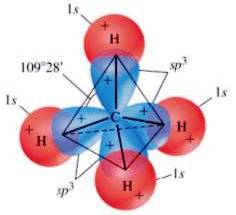
• sp3: In questa ibridizzazione abbiamo quattro orbitali ibridi isoenergetici perfettamente equivalenti orientati simmetricamente nello spazio in modo da formare angoli di 109,5°, cioè l’angolo che corrisponde alla cosiddetta struttura tetraedrica
2.1 Isomeria
L’Isomeria è quel fenomeno per cui i composti hanno la stessa formula molecolare ma diversa struttura o configurazione/conformazione,cioè diversa disposizione degli atomi nello spazio. Infatti gli Isomeri hanno medesimo peso molecolare ma diverse proprietà chimico-fisiche
2.2 Tipi Di Isomeria
L’Isomeria può essere di due tipi:
· Costituzionale: Sono composti diversi nell’ordine con cui gli atomi sono legati tra loro. A sua volta si suddivide in due forme :
-Catena: Si ha quando i composti si differenziano per il diverso modo in cui sono legati gli atomi di C: a catena lineare, ramificata e chiusa (C6 H12)
-Posizione: Gli isomeri differiscono per la posizione diversa che occupa un sostituente oppure per la posizione del doppio legame.
· Stereoisomeria:Hanno la stessa costituzione ma differiscono nella disposizione nello spazio .La stereoisomeria si divide in:
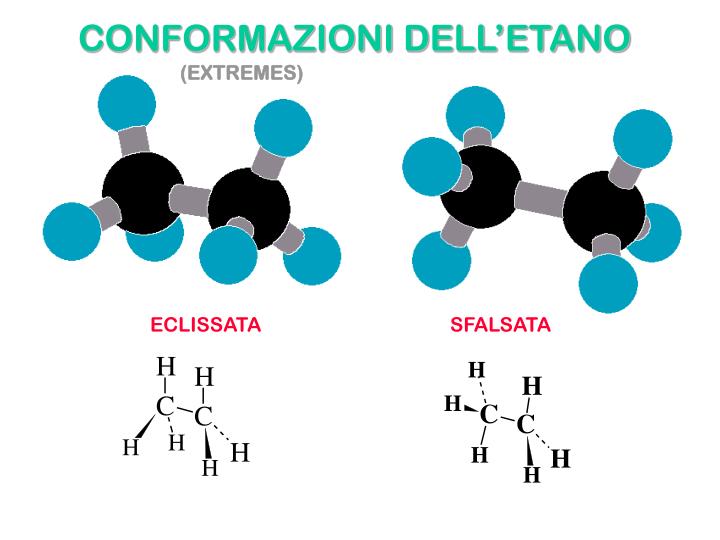
-Conformazionale:Gli isomeri sono convertibili uno nell’altro per semplice rotazione attorno ad una lega.
-Configurazionale:Gli Isomeri sono convertibili uno nell’altro solo attraverso uno scambio di posizione dei gruppi legati ad un medesimo atomo.Gli Isomeri Configurazionali si suddividono in
-Enantiomeri:Sono l’una l’immagine speculare dell’altra. Per essere speculari è necessaria la presenza di un carbonio asimmetrico o “CHIRALE”.Un carbonio asimmetrico è il carbonio ibridato sp3 legato a quattro sostituenti diversi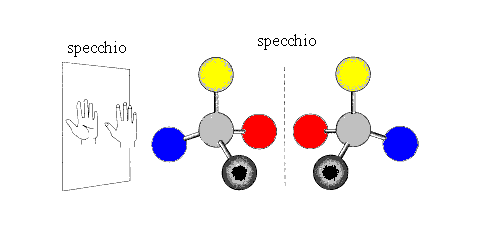
-Diasteroisomeri: non sono immagini speculari l’una dell’altra
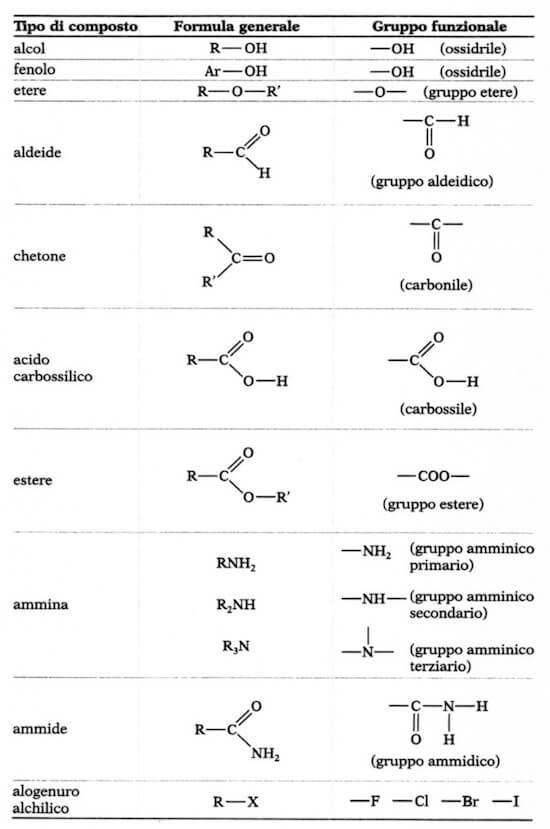
3.1 Gruppi Funzionali
In tutte le sostanze organiche, esclusi gli idrocarburi ,compaiono una limitata serie di atomi o gruppi atomici ben definiti chiamati “GRUPPI FUNZIONALI”
Ogni gruppo funzionale contraddistingue una specifica famiglia di composti organici con caratteristiche chimico-fisiche comuni
4.1 Tipi Di Reazioni Chimiche
Il sito più reattivo di una molecola organica è generalmente in corrispondenza del gruppo funzionale. Le reazioni avvengono con la rottura di legami covalenti che dà origine alla formazione di specie intermedie (radicali o ioni) dalle quali si forma poi il prodotto finale.
Nelle reazioni radicaliche le specie intermedie sono radicali ossia specie chimiche aventi un elettrone spaiato (nella rottura del legame ciascuna specie trattiene un elettrone):

Nelle reazioni ioniche le specie intermedie sono costituite da ioni in quanto la coppia di elettroni di legame viene trattenuta da una delle due specie che assume carica negativa (carbanione), mentre l'altra assume carica positiva (carbocatione):

Sono detti nucleofili i reagenti donatori di elettroni, cioè:
— gli ioni negativi (OH−, Cl−, Br−, CN−; RO− e R−, carbanioni, dove R è un radicale alchilico, cioè il residuo della molecola di un idrocarburo privata di un atomo di idrogeno);
— i gruppi atomici aventi doppietti elettronici non condivisi ().
I reagenti nucleofili reagiscono con il sito di una specie chimica in cui vi è un atomo carente di elettroni (sito elettrofilo).
Sono detti elettrofili i reagenti accettori di elettroni e cioè ioni positivi (H+, H3O+, NO2+; R+, carbocatione) o gruppi atomici carenti di elettroni (AlCl3, BF3). Reagiscono con atomi ricchi di elettroni (siti nucleofili).
4.2 Tipi di meccanismi delle reazioni organiche
Sono Due sostanzialmente i meccanismi di base delle reazioni organiche:
· Meccanismo Omolitico o Radicalico (Uguale Disposizione)
· Meccanismo Eterolitico o Polare (Diversa Disposizione)

g 4.2 Tipi di meccanismi delle reazioni organiche
· Reazione di Sostituzione
· Reazione di Addizione
· Reazione di Eliminazione
· Reazione di Ossidoriduzione:
-Riduzione:Addizione di Ossigeno
-Ossidazione:Addizione di Ossigeno e Rimozione di Idrogeno
· Reazione di Idrolisi