7.1 Le Protide
Le protide o proteine sono delle biomolecole formate,a differenza dei Carboidrati e degli Acidi Grassi,da:
· Carbonio presente per il 54%(C);
· Idrogeno presente per il 24%(I);
· Ossigeno contenente per il 7%(O);
· Azoto contenente per il 16%(N);
· Zolfo che è quasi sempre presente per il 3%(S);
L’unita funzionale fondamentale più piccola delle proteine è l’amminoacido,infatti, sono costituite da un numero elevato di aminoacidi per cui sono caratterizzate da elevati pesi molecolari e da elevate dimensioni (alcune sono visibili al microscopio elettronico), assumendo perciò carattere colloidale.
Le varie proteine differiscono per:
· Composizione di aminoacidi: possono essere presenti tutti o solo in parte
· Percentuale di aminoacidi: proteine con gli stessi tipi di aminoacidi possono contenerli in quantità diverse
· Sequenza di aminoacidi: proteine con stessi tipi e stesse percentuali di aminoacidi possono differire per l’ordine con cui questi sono disposti nella molecola proteica.
7.2 Funzioni delle proteine
Le Protide:
· Rappresentano gli elementi strutturali e funzionali più importanti nei sistemi viventi ;
· Qualsiasi processo vitale dipende da questa classe di molecola, per esempio,la catalisi delle reazioni metaboliche (enzimi), le difese immunitarie (immunoglobine),il trasporto di ossigeno (emoglobina);
· Sono macromolecole
· Ciascun proteina ha la sua struttura;
· Sebbene in natura esistano più di 300 amminoacidi,soltanto 20 sono incorporati nella proteina dei mammiferi poiché sono gli unici codificati dal DNA;
7.3 Struttura degli Amminoacidi
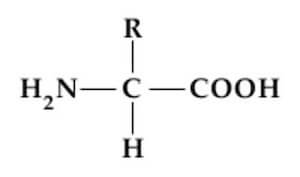
Ogni Amminoacido(eccetto la prolina) possiede un carbonio centrale,chiamato Carbonio α,al quale sono legati quattro differenti gruppi:
· Gruppo Amminico Basico(-NH2);
· Gruppo Carbossilico Acido(-COOH);
· Un atomo di Idrogeno(-H);
· Una catena laterale,diverse per ciascun Amminoacido(-R);
· Tutti gli Amminoacidi (tranne la glicina) hanno l’atomo di carbonio α legato a quattro diversi: il carbonio α (asimmetrico) è quindi un centro chiralico o otticamente attivo
· Gli Amminoacidi che hanno un centro asimmetrico nel carbonio α possono esistere in due forme speculari (D – L) dette Stereoisomeri,Isomeri Ottici o Enantiomeri.
· Le proteine contengono solo L-Amminoacidi
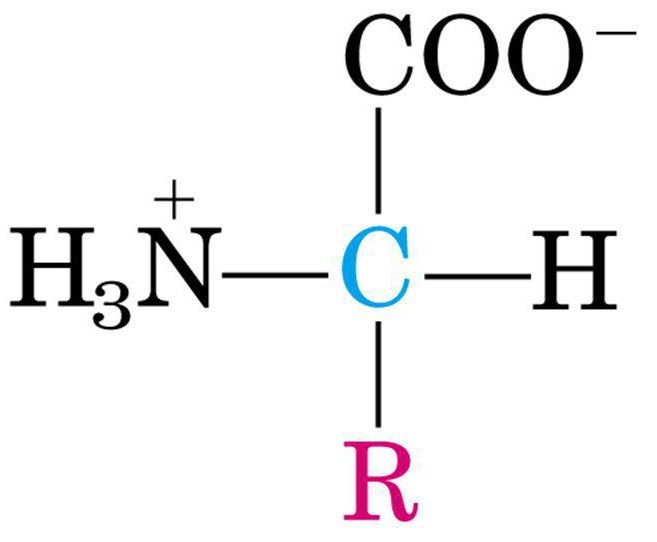
Quando un Amminoacido viene sciolto in H2O diventa una ione dipolare (ZWITTERIONE) che può agire sia come acido sia come basico.
Le sostanze che hanno questa doppia natura si definiscono Anfotere o Enfoliti.
Al PH fisiologico (valore attorno a 7,4) tutti gli amminoacidi hanno:
· Il gruppo carbossilico dissociato, si forma lo ione negativo carbossilato (-COO- )
· Il gruppo amminico protonata(-NH3)
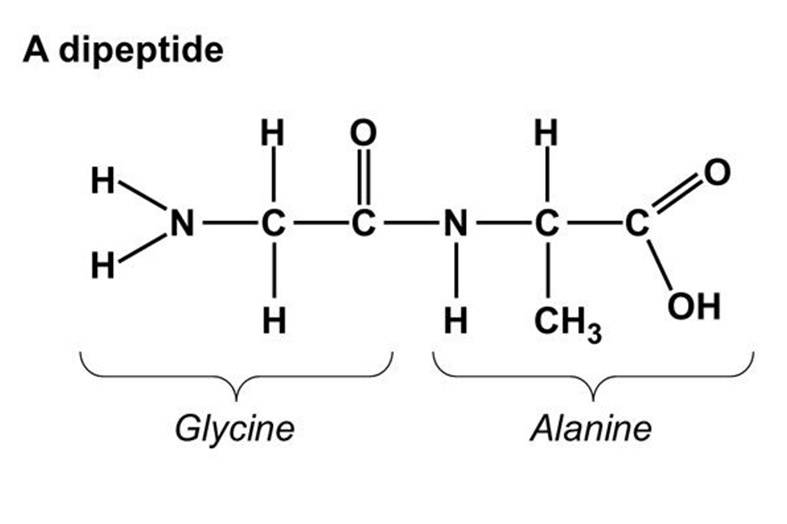
· Gli amminoacidi si collegano tra di loro tramite un legame peptidico.
· Le proprietà di ciascun amminoacido dipendono dalla catena laterali(-R) che sono i gruppi funzionali responsabili della struttura, delle funzioni e delle carica elettrica delle proteine .
· Ciò che sostanzialmente determina il ruolo di un amminoacido in una proteina è la natura della catena laterale (-R)

7.4 Classificazione Amminoacidi
· Gli amminoacidi possono essere classificati in base alle proprietà delle loro catene laterali (-R), considerando la loro polarità o non polarità al pH fisiologico e quindi la tendenza ad interagire con l’acqua.
· Gli amminoacidi con catene laterali cariche, idrofiliche, sono generalmente esposti sulla superficie delle proteine.
· I residui idrofobici, non polari, si trovano in genere all’interno delle proteine, protetti dal contatto con l’acqua .
Amminoacidi con gruppi -R alifatici (non polari):
· Glicina, alanina, valina, leucina, isoleucina, metionina, prolina. ;
· La metionina è uno dei due amminoacidi contenenti zolfo;
· La prolina ha una caratteristica struttura ad anello,formato dalla catena laterale e dal suo gruppo amminico, e differisce dagli altri amminoacidi perché contiene un gruppo imminico (R-NH-R’). E’ solo moderatamente polare.
Amminoacidi con gruppi -R aromatici:
· Fenilalanina, tirosina, triptofano ;
· Le loro catene laterali sono aromatiche ;
· Sono relativamente non polari (idrofobici);
· I gruppi -OH della tirosina ed NH del triptofano possono formare legami a idrogeno ;
Amminoacidi con gruppi -R polari,
non carichi:
· Serina, treonina, cisteina, asparagina, glutammina;
· Sono polari ma in condizioni fisiologiche sono privi di carica elettrica;
· I loro gruppi -R sono più idrofilici di quelli degli AA non polari: contengono gruppi funzionali che formano legami idrogeno con l’acqua;
· La polarità di serina e treonina è dovuta al gruppo ossidrilico (-OH), quella della cisteina al gruppo sulfidrilico (-SH), quella di asparagina e glutammina ai gruppi ammidici (-CONH2), dove sia la porzione carbonilica che quella amminica possono entrare in gioco.
Amminoacidi con gruppi -R carichi
positivamente (basici):
· Lisina, arginina, istidina;
· Possono formare legame ionico;
· Le loro catene laterali, contenenti gruppi amminici, a pH fisiologico sono ionizzate ed hanno carica positiva;
Amminoacidi con gruppi -R carichi negativamente (acidi):
• Acido aspartico, acido glutammico.
• Sono donatori di protoni.
• I gruppi carbossilici delle loro catene laterali, al pH fisiologico, sono ionizzati ed hanno carica negativa.
7.5 Struttura Amminoacidi
Dal punto di vista biochimico gli amminoacidi si possono classificare in:
· Essenziali: quegli AA che una determinata specie non è in grado di sintetizzare,devono essere introdotti nella dieta
· Non essenziali: quegli AA che una determinata specie è in grado di sintetizzare.
7.6 Classificazione delle Proteine
Le proteine possono essere classificate in due gruppi principali:
· Proteine globulari: comprendono enzimi, proteine di trasporto (per esempio albumina, emoglobina), proteine regolatrici, immunoglobuline, etc;
· Proteine fibrose:
-sono disposte in lunghi fasci o in foglietti.
-Sono insolubili in H2O per la presenza di elevate concentrazione di AA idrofobici.
-Sono adatte a ruoli strutturali (per esempio α-cheratina, collageno).
7.7 Struttura Delle Proteine
Struttura Primaria: è definita dalla sequenza lineare dei residui amminoacidi.

Struttura Secondaria:
Le strutture sono strutture dovute ad interazioni “locali” di tipo ponte-H
α-elica

· ponte-H ogni 3,6 aminoacidi
· Il legame H si instaura tra l’H dell’azoto amidico e l’O del gruppo carbonilico
· residui esterni alla spirale
b-foglietto

· legami idrogeno fra aminoacidi di catene diverse
· foglietto piegato
Struttura terziaria:

Struttura quaternaria:
Molte proteine sono costituite da una sola catena polipeptidica (proteine monomeriche)·
Alcune proteine sono costituite da 2 o più catene polipeptidiche (subunità) strutturalmente identiche o diverse (proteine multimeriche).
L’associazione di queste subunità costituisce la struttura quaternaria.
Le subunità sono tenute insieme da interazioni non covalenti.
