
ha cioè 2 elettroni spaiati nel livello più esterno. Poiché nei composti organici il C forma 4 legami covalenti, significa che un elettrone dell'orbitale 2s è promosso nell'orbitale 2p e poi si verifica l'ibridazione.
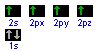
Ibridazione sp3
Vediamo, per esempio, l’atomo di carbonio nella formazione del metano (CH4): la sua configurazione elettronica esterna è s2p2; l’orbitale s è occupato da due elettroni e non potrebbe perciò formare legami covalenti con altri atomi; per giustificare la formazione dei 4 legami con altrettanti atomi di idrogeno si può ipotizzare che uno dei 2 elettroni dell’orbitale 2s, assorbendo energia (ossia “eccitandosi”), sia “traslocato” nell’orbitale 2p rimasto vuoto, realizzando una condizione in cui 4 elettroni “spaiati” occupano parzialmente 4 diversi orbitali e possono formare così 4 legami covalenti con l’elettrone “spaiato” presente nell’orbitale s degli atomi di idrogeno. Tuttavia, questo modello non è in grado di spiegare perché i 4 legami tra il carbonio e l’idrogeno nella molecola di metano sono uguali, come si può rilevare sperimentalmente. Dobbiamo perciò ipotizzare che, oltre al “salto” di un elettrone da un orbitale s a uno p, si verifichi anche una ibridazione, ossia un riarrangiamento tra 1 orbitale s e i 3 orbitali p, che porta alla formazione di 4 nuovi orbitali ibridi, detti sp3, tutti uguali tra loro, aventi una forma intermedia tra l’orbitale s e gli orbitali p. Legandosi agli orbitali s degli atomi di idrogeno, questi orbitali ibridi formano 4 legami sigma (σ) con angoli di legame di 109,5°, che determinano la forma tetraedrica di questa molecolaSi ottiene dal rimescolamento dell'orbitale s con 3 orbitali p.


I 4 orbitali ibridi si dispongono ai vertici di un tetraedro, con angoli di 109.5°.
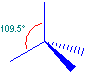

I legami che formano con gli altri elementi sono di tipo σ, perciò molto forti.
Ibridazione sp2
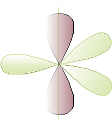
In questo caso, un orbitale s e due orbitali p si “riassemblano” formando 3 orbitali ibridi detti sp2, come si verifica nella molecola di trifluoruro di boro . a. La configurazione elettronica del carbonio prevederebbe due elettroni che completano l’orbitale 2s e due elettroni spaiati, ciascuno in un orbitale p del secondo livello: questa configurazione non giustifica il fatto che il carbonio è tetravalente! Per spiegare i tre legami del boro con tre atomi di fluoro nella molecola BF3, occorre ipotizzare che uno dei 2 elettroni dell’orbitale 2s traslochi in un orbitale 2p vuoto e l’orbitale 2s insieme ai due orbitali 2p ora esistenti formi 3 orbitali ibridi sp2. 2p 2s 1s b. La tetravalenza potrebbe essere giustificata da uno spostamento sul terzo orbitale 2p di uno dei due elettroni dell’orbitale 2s. c. Tuttavia questa nuova disposizione non riesce ancora a spiegare perché i legami carbonio-idrogeno nella molecola di metano sono tutti e quattro uguali : bisogna perciò ipotizzare l’esistenza di 4 orbitali ibridi uguali detti sp3. Anche l’atomo di carbonio può formare ibridi sp2, nei quali l’orbitale s insieme a 2 dei 3 orbitali p forma 3 orbitali ibridi equivalenti, che si dispongono su un piano, con angoli di 120° l’uno dall’altro mentre il terzo orbitale 2p non partecipa all’ibridazione e rimane su un piano perpendicolare agli orbitali ibridi. L’ibridazione sp2 si incontra nei composti contenenti doppi legami C C , C O e C N
Dopo la promozione dell'elettrone, un orbitale s si ibrida con 2 orbitali p.


I 3 orbitali ibridi si dispongono sullo stesso piano con angoli di 120°, mentre l'orbitale p non ibridato si pone perpendicolarmente agli altri 3.

Ibridazione sp
Un orbitale s forma un ibrido con un solo orbitale p: questo si verifica per esempio nei composti del carbonio contenenti tripli legami tra due atomi di carbonio (alchini). Nell’acetilene, per esempio, i due orbitali ibridi sp formano un legame sigma con un atomo di idrogeno, e uno con un atomo di carbonio, disposti a 180° l’uno dall’altro (geometria lineare), mentre le altre due coppie di orbitali p, non ibridi, formano due legami pi greco (π) tra i due atomi di carbonio.
Si ha quando un orbitale s si sovrappone ad un solo orbitale p.


I 2 orbitali ibridi ottenuti si dispongono lungo un asse con un angolo di 180°. Gli orbitali p non ibridati si pongono perpendicolari tra loro e agli orbitali ibridi.


