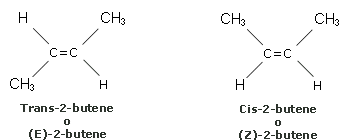Il carbonio C è l'elemento fondamentale, presente in tutti i composti organici. Come il mattone o il cemento per gli edifici è quello che costituisce la struttura portante delle molecole organiche: questo grazie alla sua particolarissima proprietà di essere tra gli unici elementoi capaci di formare lunghe catene dello stesso elemento.Questo avviene poichè l'atomo va incontro a un processo di ibridazione dei sui orbitali.Mi spiego meglio:
La configurazione elettronica del carbonio (ovvero la descrizione della disposizione degli elettroni nei sui orbitali) è :
1s2 2s2 2p
come si può notare,il carbonio ha solo 2 orbitali 2p semipieni e,pertanto,dovrebbe dare origine a 2 legami covalenti.In realtà,il carbonio è prevalentemente tetravalente,ovvero in grado di formare 4 legami con altri atomi.Si possomo creare,perciò,vari tipi di ibridazione:
- ibridazione sp3(legame singolo)poichè lo strato più esterno non è saturo,avviene il trasferimento di un elettrone dallo strato 2s allo strato 2p.Grazie a questo trasferimento,l'atomo ha a disposizione 4 elettroni disposti in 4 orbitali ibridi,con cui creare 4 legami covalenti semplici.I quattro orbitali puntano verso i vertici di un tetraedo,disponendosi a 109,5° l'uno dall'altro
- ibridazione sp2:in alternativa,dopo lo spostamento di un elettrone da 2s a 2p,si possono ibridare tra loro solo 3 orbitali,formando tre orbitali ibridi di tipo sp2,che si dispongono tra loro su un piano formando angoli di 120° e formando legami doppi
- ibridazione sp:l'ibridazione è possibile anche solo tra 2 dei 4 orbitali,formando 2 orbitali ibridi di tipo sp e lasciando 2 elettroni non ibridati.I due orbitali ibridi si dispongono a 180° l'uno dall'altro e formano un triplo legame
elemento approfondito su https://www.chimica-online.it/download/ibridazione_orbitalica.htm
Una caratteristica delle molecole organiche è quella di essere presente in più forme isomeriche,cioè composti che hanno la medesima formula molecolare,ma diversa struttura o configurazione.L'isomeria si divide in:
- Costituzionale:composti diversi nell'ordine con cui gli atomi sono legati tra loro e possono essere.
- Di catena(hanno diversi punti di fusione e ebollizione)
- Di posizione
- Stereoisomeria:hanno medesima costituzione ma differiscono nella disposizione degli atomi nello spazio.Può essere:
- conformazionale(gli isomeri sono convertibili l'uno sull'altro solo se ruotano attorno a un legame e possono avere configurazione sfalsata o ecclissata
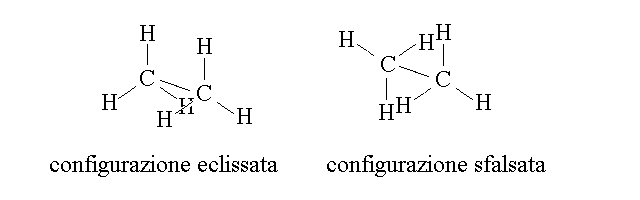
- configurazionale(gli isomeri sono convertibili l'uno sull'altro solo per rottura di un legame e possono essere diasteroisomeri o enantiomeri)
Isomeri configurazionali:
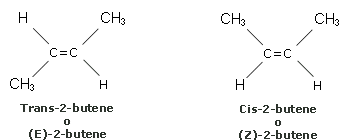
sono una l'immagine speculare dell'altra.Affinchè esistano è necessaria la presenza di un carbonio asimettrico o chirale(un carbonio ibridato sp3 legato a quattro sostituenti diversi) Gruppi funzionali
In ogni sostanza organica,esclusi gli idrocarburi,compare una limitata serie di atomi a gruppi atomici ben definti chiamati gruppi funzionali,ciascuno dei quali si caratterizza per proprietà chimico-fische diverse
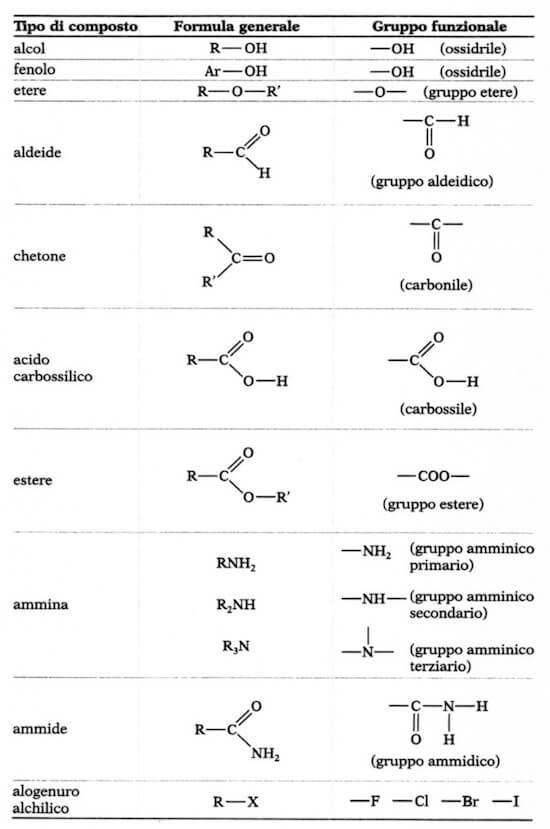
i gruppi funzionali:
- sono le unità funzionali mediante le quali classificare i composti organici
- sono i siti delle REAZIONI CHIMICHE
Meccanismi di reazione delle molecole organiche
- reagenti elettrofili
- reagenti nucleofili
- reagenti radicali
Vari meccanismi delle reazioni:
- meccanismo omolitico o radicalico(gli elettroni di legami vengono divisi ugualmente nei due atomi,non portando perciò alla formazione di una molecola polare)
- meccanismo eterolitico o polare(gli elettroni di legame vengono spostati verso un atomo formando una molecola polare
Tipologie di reazioni chimiche organiche: