Le proteine sono biomolecole questa volte non più formate da 3 elementi,bensi' da 4;ovvero Carbonio,Idrogeno;ossigeno e azoto insieme ad altri elementi variabili(ex zolfo).
hanno proprietà funzionali e strutturali e qualsiasi processo vhimivo dipende da questa classe di molecole( ad esempio la catalisi delle reazioni metaboliche,le difese immunitarie,il trasporto di ossigeno,il trasporto di nutrienti e il movimento.
Le proteine sono polipeptidi formati dall'unione di amminoacidi,che sono perciò l'elemento fondamentale delle proteine.Sebbene in natura esistano più di 300 amminoacidi,soltanto 20 sono sono incorporate nelle proteine dei mammiferi poichè sono gli unici codificanti del DNA.
La caratteristica strutturale comune a tutte è di essere un polimero tridimensionale.
Ogni amminoacido(ecceto la prolina)possiede un carbonio centrale,chiamato carbonio alfa,al quale sono legati 4 differenti gruppi,in particolare:

In realtà,a livello di Ph fisiologico,il gruppo COOH perde un atomo di idrogeno che si lega con il gruppo amminico,diventando cosi
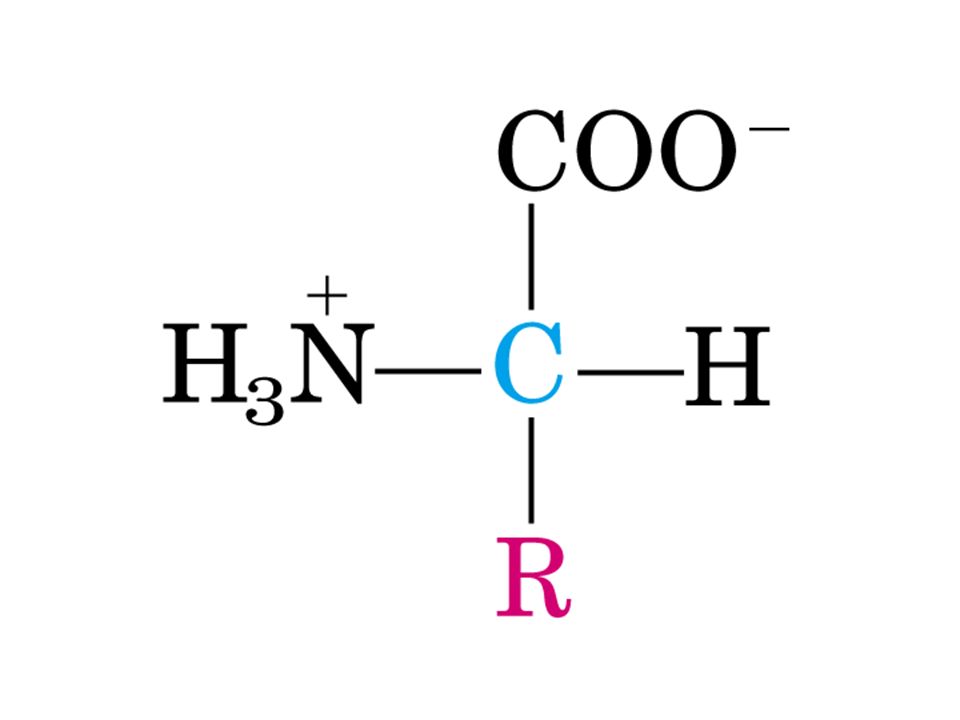
Tutti gli amminoacidi (tranne la glicina) hanno l'atomo di carbonio alfa legato a quatrro gruppi diversi:il carbonio alfa (asimmetrico)è quindi un centro chiralico o otticamente attivo.
li amminoacidi che hanno un centro asimmetrico nel carbonio alfa possono esistere in due forme speculari (D e L) dette Stereoisomeri,isomeri ottici o enantiomeri.
N.B: Le proteine sono formate da L-Amminoacidi.
Quando un amminoacido viene sciolto in acqua diventa uno ione dipolare (zwitterione che può agire come acido che come basico
Lo sostanze che a
hanno questa doppia natura si definiscono anfotere.
nelle proteine i gruppi carbossilici e a,,imici sono uniti da legami peptidici,in cui il gruppo carbossilico si lega con il gruppo amminico formando una molecola di H2O

Le proprietà di ciascun amminoacido dipendono dalla catena laterale,che sono i gruppi funzionali responsabili della struttura e delle funzioni
Per questo gli amminoacidi possono essere classificati in base alle proprietà delle loro catene laterali,considerando la loro polarità o non polarità al Ph fisiologico e quindi la loro tendenza a interagire con l'acqua.
I VARI GRUPPI DI PROTEINE
AMMINOACIDI APOLARI
Essendo apolare sono idrofobi e non ricevono nè cedono proteine e non formano legami idrogeno e ionici.Ad essi fanno parte :
AMMINOCIDI CON GRUPPO -R AROMATICO
Tra gli amminoacidi vi sono anche quelli che presentano il gruppo -R aromatico.Essi sono:
-Fenilanina,triptofano,fenilanina.Il gruppo -OH della tirosina e NH del triptofano possono formare legami idrogeno
AMMINOACIDI CON GRUPPI -R POLARI,NON CARICHI
Presentano sulla catena laterale dei gruppi polari,come OH.Sono polari ma non carichi.
La polarità di serina e treonina è dovuta dal gruppo carbossilico -OH,quella della cisteina da gruppo sulfidrilico -SH,quella della asparagina e glutammina ai gruppi amminici -CONH2
AMMINOACIDI CON GRUPPO -R CARICO POSITIVAMENTE(BASICI)
Le loro catene laterali,contenenti gruppi amminici,a Ph fisiologico sono ionizzate ed hanno carica positiva
AMMINOACIDI CON GRUPPI -R CARICHI NEGATIVAMENTE(ACIDI)
Sono donatori di protoni e possono formare legami ionici
Dal punto di vista biologico gli amminoacidi si posso classificare in :
PROTEINE GLOBULARI E FIBROSE
Le proteine si possono dividere in globulari e fibrose
PROTEINE GLOBULARI
Le catene polipeptidiche sono ripiegate e assumono forma compatta.globulare o sferica.Contengono più tipi di strutture secondaria e comprendono enzimi,proteine di trasporto,proteine regolatrici e immunoglobine.
PROTEINE FIBROSE
Hanno catene polipeptidiche disposte in lunghi fasci o foglietti.In genere presentano un unico tipo di struttura secondaria.Sono insolubili in acqua per la presenza di molti amminoacidi idrofobici

I VARI TIPI DI STRUTTURA
I singoli amminoacidi in una catena peptidica sono chiamati residui amminoacidi
STRUTTURA PRIMARIA
La struttura primaria di una proteina è definita dalla sequenza lineare dei residui amminoacidi uniti da legami covalenti(peptidici)
STRUTTURA SECONDARIA(FORMANO SOLO LEGAMI H)
Sono dovute ad interazioni di tipo H e possono essere a-elica e b-foglietto
a-elica
(dovute ad interazioni H tra il gruppo carbonilico e il gruppo amminico.Il legame H si instaura dall h dell'azoto amidico e l'O del gruppo carbonilico.I gruppi R sono esterni alla spirale:Può essere sinistrosa o destrosa
b-foglietto
legami idrogeno fra amminoacidi e catene diverse,ha la forma di foglietto piegate
STRUTTURA TERZIARIA
La struttura terziaria è la conformazione tridimensionale,avvolta,di una proteina.
la struttura terziara è determinata dalla struttura primaria di una catena peptidica
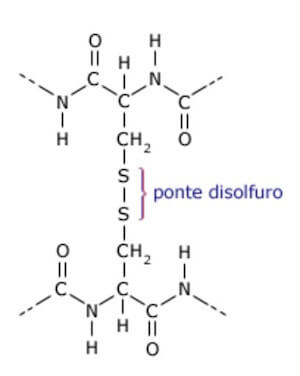
Quando una proteina si avvolge su se stessa,gli amminoacidi che si trovano in regioni lontane dalla sequenza polipeptidica possono ugualmente interagire tra loro.la struttura terziaria può essere unita da ponti di solfuro.
STRUTTURA QUATERNARIA
Molte sono costituite da una sola catena polipeptidica(proteine monomeriche).altre sono costituite da 2 o più catenepolipeptidiche8subunitò) strutturalmente identiche o diverse (proteine multimeriche).L'associazione di queste subintà costituisce la struttura quaterniaria.Le subunità sono tenute insieme da interazioni non covalenti(ex:emoglobina)